Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
ВСЯ ХИМИЯ за 15 секунд #shorts #youtubeshorts #химия
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
- Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса:

- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:

Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
ПРАВИЛО 3 ВОРОВ в Химии #shorts #youtubeshorts #химия
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
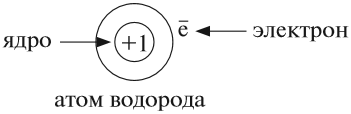
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
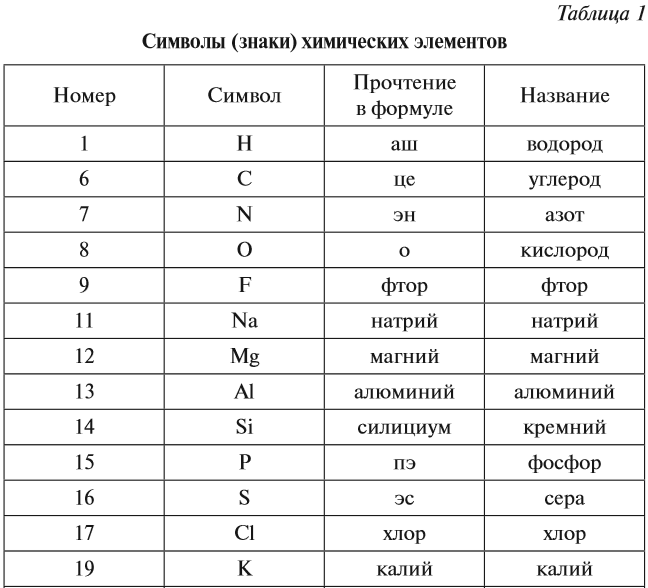
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
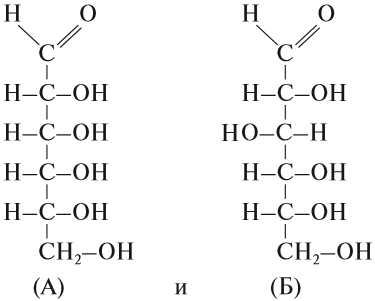
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.

Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
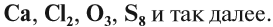
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
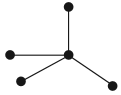
- Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
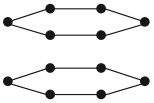
- Графит — атомы углерода находятся в одной плоскости;

- Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
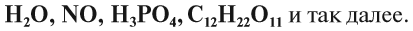
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:

В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).

Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.

Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):

2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
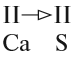
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
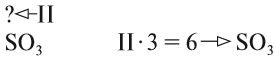
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:

Задание 1.2. Определите валентности элементов в соединениях:
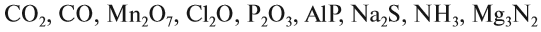
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
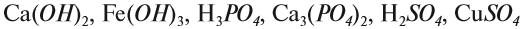
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
- Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
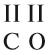
- Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
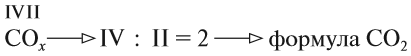
- В остальных случаях индексы определяют «крест-накрест»:
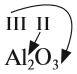
Задание 1.4. Составьте химические формулы соединений:
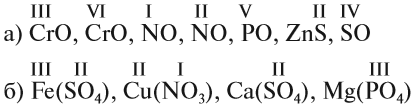

Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
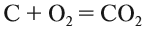
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции.
Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
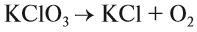
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
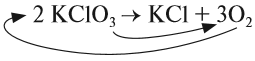
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
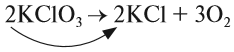
Теперь между правой и левой частями уравнения можно поставить знак равенства:
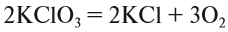
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
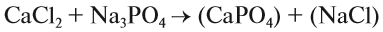
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
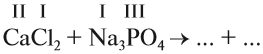
2. Перенесём эти числа в правую часть уравнения:
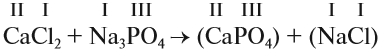
3. Составим химические формулы полученных веществ по валентностям составных частей:
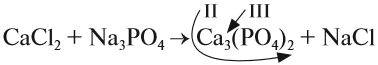
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
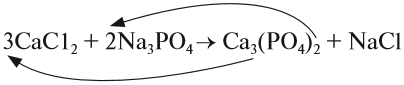
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
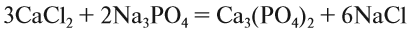
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
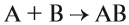
Здесь из двух и более веществ образуется одно вещество:
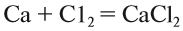
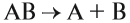
Здесь из одного вещества получаются два вещества и более веществ:
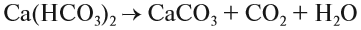

Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
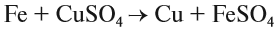
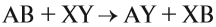
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
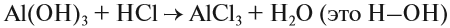
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
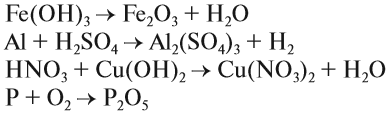

Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Источник: himi4ka.ru
урок 1. 11кл. Что такое бизнес-идея (1). 11 класс, 2 четверть Раздел Бизнесидеи из науки математика, химия Тема 1

Единственный в мире Музей Смайликов
Самая яркая достопримечательность Крыма

Скачать 0.53 Mb.
11 класс, 2 четверть
Раздел: Бизнес-идеи из науки: математика, химия
Тема 1: Что такое бизнес-идея. Пассивные конструкции с краткими страдательными причастиями
Цель урока для учащихся: 11.4.3 – соблюдать синтаксические (при пассивных конструкциях с возвратными глаголами и краткими страдательными причастиями, в безличных предложениях) и стилистические нормы;
Ключевые слова: Бизнес-идея, Актуальный, Рентабельный, Потребитель.
Термины: грамматическая основа предложения, простое и сложное предложение, активная и пассивная конструкция
Этапы урока
Изучи карту урока на стр. 41 (в зеленой рамке).
Подбери синонимы к слову идея — мысль, замысел.
Объясни лексическое значение ключевых слов темы:
Бизнес-идея – это концепция бизнеса, которая связана с пониманием ценности, предлагаемой потребителю. Она может быть как собственной (новой, оригинальной, рожденной впервые), так и заимствованной извне («враждебное» поглощение через приобретение компаний, создание совместных предприятий
Актуальный – Очень важный для настоящего времени.
Рентабельный – Целесообразный или то, что оправдывает расходы компании.
Потребитель – Человек, который хочет сделать заказ или что-то приобрести.
П 
 овтори определение грамматической основы и строение простого и сложного предложения (смотри слайды ниже) :
овтори определение грамматической основы и строение простого и сложного предложения (смотри слайды ниже) :
Чтобы двигаться дальше, выясните, что такое активная и пассивная конструкция, изучив правило на стр. 43.
Обратная связь.
Выполни упр. 57, преобразовав приведенные активные конструкции в пассивные. Записывайте только получившиеся пассивные конструкции, подчеркивая в них грамматические основы и объект действия, выраженный дополнением (как в образце выполнения).
Уважаемый учащийся, все выполненные письменно задания необходимо отправить на проверку учителю.
Источник: topuch.com
СОР 11 класс Русский язык «Бизнес-идеи из науки: математика, химия»
Суммативное оценивание за раздел «Бизнес-идеи из науки: математика,
химия»
Класс 11 « »
Вид речевой деятельности Слушание и говорение
Цель обучения 11.1.4 Участвовать в деловой беседе, решая проблему и
достигая договорённости
11.4.2 Использовать различные
изобразительновыразительные средства языка, стилистические
фигуры в соответствии с целью и ситуацией общения
Критерий оценивания Обучающийся
Участвует в деловой беседе, формулируя проблему и
предлагая пути решения
Использует соответствующие речевой ситуации
изобразительно-выразительные средства/
стилистические фигуры
Уровень мыслительных навыков Синтез, анализ, применение Применение
Время выполнения 20 минут
Задания.
Прослушайте текст «Инвестор с секретами». Подумайте, как знание математики помогло ученому реализовать
бизнес-идеи?
Представьте, что Вы в компании начинающих молодых бизнесменов решили поделиться своими идеями, как
увеличить доход, используя знание математики. Озвучьте проблемы, с которыми может столкнуться
начинающий бизнесмен и предложите идеи, как решить эти проблемы.
Включите в свою речь изобразительно-выразительные средства/стилистические фигуры, которые позволят
сделать вашу речь более убедительной.
Инвестор с секретами
Родившийся в 1938 году Джеймс (Джим) Харрис Саймонс вырос в Бруклине, пригороде Бостона. Как пишет
Bloomberg, уже в три года будущий учёный задавался математическими вопросами: например, почему в машине
может кончиться бензин, если при делении его количества наполовину, сколько бы раз ни повторять этот
мысленный эксперимент, всякий раз будет что-то оставаться (тем самым маленький Джим открыл для себя
знаменитые парадоксы Зенона).
Неудивительно, что после окончания средней школы он поступил в Массачусетский технологический
институт, где изучал математику. А точнее, то решал по ночам сложные задачи, то сражался с друзьями, такими же
увлеченными математиками, в покер. После получения степени бакалавра Саймонс отправился в Калифорнийский
университет в Беркли, где, к удивлению своего научного руководителя, всего за два года получил докторскую
степень по математике. Молодой ученый остался в научной среде: вначале преподавал в родном вузе Массачусетса,
затем в Гарварде.
Еще в начале 1960-х Саймонс с приятелями начали заниматься бизнесом: они вложили свои небольшие
сбережения в завод по производству виниловых напольных покрытий. Дела у завода пошли хорошо, и в 1974 году
Саймонс с партнерами решили инвестировать $600 тыс. в
11
товарные фьючерсы. В то время контракты на сахар взлетели ввысь, и спустя всего семь месяцев начинающие
инвесторы имели уже $6 млн. И тогда Саймонс основал Monemetrics – инвесткомпанию, предшественницу
Renaissance. Его идея состояла в том, чтобы использовать математическую модель для торговли валютой. Один из
его бывших коллег по Институту военного анализа Леонард Баум разработал соответствующую модель, а другой
его коллега, уже по университету, Джеймс Экс, выяснил, что ее можно использовать для торговли чем угодно – от
пшеницы до сырой нефти. Математические модели были улучшены, и в 1988 году Саймонс с Эксом основали
хедж-фонд, который назвали Medallion – в память о медалях, заработанных ими в различных состязаниях ученых.
1990-е годы оказались для Medallion весьма успешными. В 1994 году его доходность составила 71%, а в
2000-м и того больше – 98,5%. В среднем же за 11 лет существования фонд, в котором работали 148 человек,
продемонстрировал среднегодовую доходность в 43,6%. И это несмотря на то, что Саймонс к тому моменту по
разным причинам оказался без своих изначальных партнеров и разработчиков моделей.
https://www.rbc.ru/business/06/03/2015/54f84d889a7947362ee085cb
Критерий оценивания № задания Дескриптор Балл
Обучающийся
Участвует в деловой беседе, формулируя проблему и предлагая пути решения 1 составляет речь в соответствии с темой 1
составляет речь в соответствии с выбранной позицией 1
формулирует проблему 1
предлагает пути решения проблемы 1
активно взаимодействует с участниками беседы 1
Использует соответствующие речевой ситуации изобразительновыразительные средства/ стилистические фигуры 2 уместно использует изобразительновыразительные средства/ стилистические фигуры 2
строит речь в соответствии с нормами языка 2
Всего баллов 9
Автор maks11 Скачивания 6 Просмотры 271 Первый выпуск Мар 3, 2023 Обновление Мар 3, 2023 Оценка 0.00 звёзд 0 оценок
Источник: keyshub.ru
